(观察者网讯)3月24日,港股上市公司腾盛博药(股票代码:2137.HK)发布2022年度全年财务业绩及公司最新进展。其中提到,腾盛博药已决定结束新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法项目,并已停止其生产工作以将资源重新转向核心项目。

腾盛博药网站截图
公开资料显示,腾盛博药成立于2018年,目前在位于罗利-达勒姆、旧金山湾区、北京和上海等生物技术中心开展业务。2021年7月13日,公司在香港联合交易所正式挂牌上市,股票代码为2137.HK。
安巴韦单抗和罗米司韦单抗是新冠病毒中和抗体联合治疗药物,由腾盛博药与清华大学和深圳市第三人民医院共同成立的子公司腾盛华创医药技术(北京)有限公司所共同研发,属于从 COVID-19 康复期患者中获得的非竞争性新型严重急性呼吸系统综合症病毒 2(SARS-CoV-2)的单克隆中和抗体。
2021年12月长效安巴韦单抗和罗米司韦单抗联合疗法获中国国家药监局批准,通过以静脉输注,两种药物顺序给药的方式,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重 ≥40 kg)新型冠状病毒感染(COVID-19)患者。其中青少年(12-17岁,体重≥40kg)适应症人群为附条件批准。
由于在生产质量管理规范(GMP)认证上花费较长时间,直到8个月后,安巴韦单抗和罗米司韦单抗开始商业化。腾盛博药表示,自安巴韦单抗和罗米司韦单抗联合疗法商业化上市以来,已基本将该药物的全部适销产品销售到全国25个省份的358家医院,获得收入约人民币5,160万元。作为其确保人道主义援助和协助控制疫情爆发承诺的一部分,公司在该抗体药物商业化上市前已向全国多达21个城市的22家医院捐赠了近3,000人份的抗体用于紧急救治。
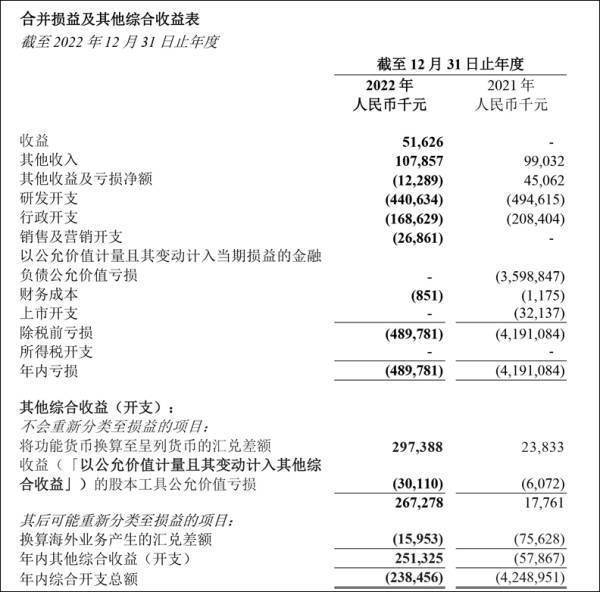
合并损益表显示,年收入由零增加至人民币5160万元的主要原因是安巴韦单抗╱罗米司韦单抗联合疗法在中国的商业化。
公告指出,2023年1月,中国国家卫生健康委员会在《新型冠状病毒感染诊疗方案(试行第十版)》及《新型冠状病毒感染重症病例诊疗方案(试行第四版)》中重申安巴韦单抗和罗米司韦单抗注射联合疗法。多个独立实验室的活病毒和嵌合病毒实验检测数据表明,长效安巴韦单抗和罗米司韦单抗联合疗法对常见新冠病毒变异株均保持活性,包括B.1.1.7(阿尔法, Alpha)、B.1.351 (贝塔, Beta)、P.1(伽马, Gamma)、B.1.429 (伊普西龙,Epsilon)、B.1.617.2 (德尔塔, Delta)、AY.4.2 (德尔塔+,Delta Plus)、C.37 (拉姆达, Lambda) 、B.1.621 (缪, Mu)、B.1.1.529(奥密克戎, Omicron),以及BA.1.1、 BA.2、 BA.2.12.1、BA.4/5 、BF.7 (奥密克戎亚型变异株)。
公告提到,做出这一决定的因素包括基于不断演变的新冠疫情趋势,和美国卫生和公共服务部(HHS)于2023年5月结束新冠肺炎联邦公共卫生紧急状态(PHE)的计划,以及被拖延的公司受托生产企业(CDMO)的现场监管核查。腾盛博药公司正在与美国FDA沟通,在完成所有监管要求后,将在适当的时候撤回紧急使用授权(EUA)申请,并会与中国NMPA进一步沟通,在2023年三季度完成监管机构的各项要求后,撤回生物制品许可申请(BLA)。腾盛博药公司预计未来无论在中国或美国以及其他地区,不会再从该联合疗法中产生可观收入。
值得注意的是,据北京商报2022年7月报道,原腾盛博药大中华区总裁兼总经理罗永庆曾表示,在研发安巴韦单抗和罗米司韦单抗的时候,公司前后投入了超过2亿美元,以确保研发和商业化的顺利进行。
3月27日收盘,腾盛博药股价为5.010港元/股,微跌0.40%。而时间线拉长来看,其相较于此前高点已经跌去约六成。














